Попов В.Ю., Райкова А.С., Бржеский В.В. Современные возможности применения ботулинического токсина типа А при патологии слезных органов глаза (обзор литературы).
Современные возможности применения ботулинического токсина типа А при патологии слезных органов глаза (обзор литературы).
ГБОУ ВПО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России (г. Санкт-Петербург, Россия).
Попов Владимир Юрьевич – аспирант кафедры офтальмологии с курсом клинической фармакологии.
Райкова Анна Сергеевна - аспирант кафедры офтальмологии с курсом клинической фармакологии.
Бржеский Владимир Всеволодович - доктор медицинский наук, профессор, заведующий кафедрой офтальмологии с курсом клинической фармакологии.
Резюме:
В последние годы препараты ботулинического токсина типа А стали активно применять во многих областях клинической медицины. Исключение не составляет и офтальмология.
Ботулотоксин сегодня успешно используют при патологических состояниях, характеризующихся гиперпродукцией слезной жидкости, а в некоторых случаях – при ее дефиците.
С другой стороны, применение ботулинотерапии при коррекции мимических морщин, блефароспазма часто вызывает развитие ксероза эпителия глазной поверхности. Однако и это свойство ботулотоксин анашло позитивное отражение в активном применении этого препарата в экспериментальном моделировании синдрома «сухого глаза» на лабораторных животных.
В силу этого, применение ботулотоксина при патологии, характеризующейся нарушением слезопродукции, имеет важное клиническое значение и является перспективным терапевтическим направлением.
Ключевые слова: ботулинический токсин типа А, ботулинотерапия, слезотечение, синдром «сухого глаза», слезная железа.
Abstract:
Modern possibilities of using botulinum toxin type A in the pathology of eye lacrimal organs (review)
V. Yu. Popov, A.S. Raykova, Brzheskiy V.V.
Saint Petersburg State Medical Pediatric University, Russia
Popov Vladimir Yurievich - graduate student of Ophthalmology and clinical pharmacology department
Raykova Anna Sergeevna - graduate student of Ophthalmology and clinical pharmacology department
Brzheskiy Vladimir Vsevolodovich - D. Med. Sc., Prof., head of Ophthalmology and clinical pharmacology department.
Recently, preparations of botulinum toxin type A actively applied in many areas of medicine. Ophthalmology is notexclusion. Botulinum toxin is successfully used in pathological conditions characterize by hypersecretion of tear fluid, and reducing it.
On the other hand, use of Botulinum in the correction of facial wrinkles, blepharospasm often to produce of eye surface epithelium xerosis. However, this characteristic of botulinum toxin apply in the experimental modelling of a dry eye disease on laboratory animals based on tearing reduction.
Therefore, use of botulinum toxin in the pathology characterize by excessive of tear production has important clinical value and is promising therapeutic approach.
Keywords: botulinum toxin type A, botulotoxiny therapy, epiphora, dry eye syndrome, lacrimal gland.
Опубликовано: Клиническая офтальмология, Том 16, 2016, №2, стр. 93-97.
DOI: 10.21689/2311-7729-2016-16-2-93-98
Ботулинический токсин известен человечеству с древних времен, как один из сильнейших ядов.
Попытка выделить токсин впервые была предпринята в 1920г. H.Sommer, однако только в 1970-е годы A.В.Scott впервые использовал его для устранения косоглазия[1].
К настоящему времени накоплен значительный опыт успешного клинического применения ботулинического токсина в различных областях медицины: неврология, дерматология, косметология, стоматология, гинекология, урология, отоларингология, офтальмология и пр.
В силу этого обстоятельства, в 2000г. он был назван «загадочной молекулой века», а в 2008г. в России зарегистрирована Межрегиональная общественная организация специалистов ботулинотерапии (МООСБТ), занимающаяся междисциплинарным изучением ботулотоксина [2].
Как известно, ботулинический нейротоксин является продуктом бактериального обмена веществ грамположительной спорообразующей палочки Clostridium botulinum, которая распространена повсеместно, преимущественно в почве [2,3].
В настоящее время известно 8 серологических подтипов ботулотоксина: А, В, С1, С2, D, E, F и G. Из них самым сильнодействующим является тип А, который впервые появился на фармацевтическом рынке в качестве препарата Ботокс, Botox (Allergan, Inc., Irvine, CA).
Ботулотоксин А (БТ-А) представляет собой двухосновный полипептид, имеющий две основные составные части – нейротоксиновые полипептидные цепочки и крупные пептидные молекулы гемагглютининов и нетоксичных негемагглютининовых протеинов. Такая структура препятствует как расщеплению нейротоксина, так и быстрой диффузии его в окружающие ткани, обеспечивая тем самым локальность воздействия.
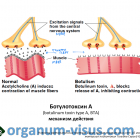
Действие БТ-А проявляется в области холинергических синапсов. Посредством деактивации комплекса SNARE (solubleN-ethylmaleimide-sensitive-factor attachment receptor), который представляет собой белковый комплекс, осуществляющий слияние внутриклеточных транспортных везикул с клеточной мембраной или органеллой-мишенью, токсин блокирует высвобождение нейротрансмиттера ацетилхолина из пресинаптических терминалей холинергических нейронов, тем самым прекращая передачу возбуждения.
Фармакологическим эффектом рассмотренного процесса является стойкая хемоденервация, а клиническим проявлением – расслабление мышечных структур и развитие «вялого» паралича.
Процесс внедрения токсина в пресинаптическое окончание и блокады пресинаптической мембраны занимает от 1 до 3 дней, поэтому клинический эффект начинает проявляться только через несколько суток. В промежутке от 1 до 2 мес. после воздействия ботулинического токсина в зоне введения гистологическими исследованиями установлено образование новых нервных окончаний, с формированием новых нервно–мышечных синапсов.
Этот процесс получил название спраутинг (от англ. sprout – «пускать ростки»). В большинстве случаев прежняя мышечная активность восстанавливается через 3–6 мес. после локального введения токсина, но нередко это может произойти через год и более [2,3].
Наиболее чувствительными к действию БТ-А являются нервно-мышечные синапсы поперечнополосатых мышц, однако он воздействует и на вегетативные холинергические нервные окончания, приводя к снижению секреции, в том числе и слезных желез.
Как известно, основная слезная железа относится к альвеолярно-трубчатым железам и состоит из многочисленных долек, каждая из которых включает в себя некое количество ацинусов. К базальной мембране каждого из них примыкают миоэпителиальные клетки, при сокращении которых происходит пассаж содержимого в выводной проток.
Эфферентная иннервация слезной железы осуществляется за счет парасимпатических волокон, промежуточного нерва и симпатических волокон, которых отходят от внутреннего сонного сплетения, составляя глубокий каменистый нерв.
Что касается афферентной части рефлекторной дуги слезообразования, то она начинается роговично-конъюнктивальными и носовыми рецепторами первой и, частично, второй ветви тройничного нерва.
По мнению большинства исследователей, центр слезообразования (слезное ядро) находится в мосту головного мозга, примыкая к задней части верхнего слюноотделительного ядра. Аксоны его вегетативных нейронов заканчиваются на клетках крылонебного узла, который участвует в иннервации слезной железы. В силу этого обстоятельства, БТ-А воздействует как на мышечный компонент функционирования слезной железы, так и на ее иннервацию. Рассмотренные обстоятельства явились обоснованием к применению в последние годы БТ-А в клинической офтальмологии.
Вместе с тем, на сегодняшний день достаточно известны как позитивные, так и негативные эффекты рассматриваемого препарата. И как бы это не выглядело парадоксальным, и те, и другие легли в основу практического применения БТ-А в офтальмологии.
Наиболее широкое практическое распространение получили методы лечения ботулотоксином, в основе которых лежит свойство препарата снижать слезопродукцию, особенно в тех случаях, когда слезотечение традиционными методами устранить не удается.
Как известно, тягостное слезотечение негативно влияет на качество жизни как взрослых, так и детей. По данным B.Coskun еt al. (2012) частота обращений с данными жалобами составляет от 3% до 5% среди впервые обратившихся к офтальмологу [4].
Наиболее частым причиной слезотечения является нарушение оттока слезной жидкости из конъюнктивальной полости вследствие непроходимости слезоотводящих путей на различном уровне.
В настоящее время основным способом хирургического лечения т.н. неустранимого слезотечения (при отсутствии эффекта или неосуществимости традиционных пластических операций – дакриоцисториностомии в различных модификациях, каналикулоцисториностомии и др.) является лакопротезирование [5].
Однако результативность лакопротезирования остается относительно невысокой, что, в сочетании с его тpавматичностью, существенно ограничивает возможности широкого применения данного вмешательства. В силу этого обстоятельства, все большее внимание привлекают малоинвазивные методики лечения патологии слезоотводящих путей.
По данным ряда авторов, одним из направлений такой терапии является введение БТ-А в основную слезную железу. Так, A.H.Tu et al. (2005) для устранения эпифоры успешно применили инъекции БТ-А в основную слезную железу женщин, перенесших химиотерапевтическое лечение по поводу рака молочной железы (у них слезотечение на почве стеноза слезных канальцев встречается в 50-77% случаев). При этом положительный клинический эффект авторы подтвердили объективными способами функциональной оценки слезопродукции [6].
В 2014 году H.S.Eustis и A. Babiuch применили инъекции БТ-А в слезную железу при лечении трех детей с эпифорой, причиной которой были атрезия слезных точек, а также облитерация слезных канальцев (после травмы век – в одном случае и перенесенного герпетического блефарита–в другом). Положительный эффект у всех был достигнут на 7 день и сохранялся на протяжении 7 месяцев [7].
Кроме этого, K.Ziahosseini et. al. (2015) представили данные о результатах инъекций БТ-А пациентам с жалобами на слезотечение, возникшего на почве стеноза носослезного протока, обструкции канальцев и/или общего слезного канальца и окклюзии слезной точки [8]. Авторы предложили пациентам инъекции ботулотоксина в качестве альтернативы «традиционному» хирургическому лечению.
Результаты инъекций в слезную железу БТ-А оказались достаточно эффективными, составив достойную альтернативу реконструктивным хирургическим вмешательствам.
Весьма серьезной проблемой дакриологии является эпифора, сопутствующая инволюционным изменениям вспомогательных органов глаза: выворот нижнего века, гипертрофия слезного сосочка, выворот слезной точки при понижении тонуса круговой мышцы глаза.
Слезотечение вследствие указанных причин Г.Ф. Малиновский (2005) определил термином «функциональная эпифора» [9]. K.W. Whittaker et al. (2003) также рассматривают «функциональное слезотечение», включив в него, кроме перечисленных выше, состояния, когда при отсутствии анатомических изменений и хорошей пассивной проходимости слезоотводящих путей активное слезоотведение отсутствует или резко нарушено.
В своем пилотном исследовании, авторы, также предложив таким пациентам в качестве альтернативы хирургическому лечению инъекции в слезную железу БТ-А, получили у 14 пациентов в возрасте от 41до 84 лет с «функциональным» слезотечением положительный эффект. У 8 из них (57%) он наблюдался в течение 6 месяцев, у 5 (36%) – в течение 4-5 месяцев и лишь у одного (7%) сохранялись жалобы на слезотечение [10].
Наряду с эпифорой на почве нарушения слезоотведения, достаточные сложности вызывает слезотечение, развивающееся на почве повышенной продукции слезной жидкости, на фоне активной проходимости слезоотводящих путей.
Одной из причин подобного рефлекторного слезотечения является вегетативная дисфункция в коленце лицевого нерва – т.н. синдром «крокодиловых слез» (синдром Ф.А. Богорада), характеризующийся усиленным слезоотделением как во время приема пищи, так и при ее обонянии [11].
Единственным способом борьбы с синдромом «крокодиловых слез» (слезоотводящие пути проходимы!) длительное время служило оперативное вмешательство, заключающееся в субтотальной резекции пальпебральной доли основной слезной железы и в блокировании ответвлений лицевого нерва в местах контакта с железой. По мнению D.Е. Baranano и N.R.Miller (2004), данный способ лечения имеет ограниченную эффективность [12], в сочетании с безусловно высокой травматичностью.
Рядом зарубежных авторов в качестве альтернативного способа лечения таких больных была предложена методика трансконъюнктивального введения в пальпебральную долю основной слезной железы ботулотоксина А. Примечательно, что именно в целях компенсации рефлекторного слезотечения началось активное внедрение рассматриваемого метода лечения в офтальмологическую практику.
В частности,R. Riemann еt al. (1999) получили позитивный эффект (на протяжении 6 месяцев) от однократного использования БТ-А у пациента, страдающего синдромом «крокодиловых слез» в комбинации с двухсторонним параличом лицевого нерва [13]. В 2002 году Y.M. Delaney и J.S. Elston впервые описали позитивные результаты применения рассматриваемого препарата при двустороннем слезотечении во время приема пищи у пациента с синдромом Гийена-Барре (острая идиопатическая полинейропатия).
При этой форме генерализованной периферической полинейропатии более чем у 50% пациентов вовлечен лицевой нерв, однако двусторонняя форма «патологического» слезотечения встречается редко [14].
В 2004 году D.E.Kyrmizakis et al. провели исследование эффективности инъекций БТ-А у 11 пациентов с синдромом Фрея (околоушно-височный гипергидроз), а также у двух больных с монолатеральным синдромом «крокодиловых слез» и проанализировали состояние слезопродукции у этих пациентов через 1 и 24 недели после лечения.
У 31% из них показатели слезопродукции уменьшились через неделю, а на 24-й неделе после введения препарата - в 23% случаев [15]. Кроме этого, K.Falzon et al. (2010) подтвердили положительный эффект действия БТ-А, применив последний в лечении пациентов с синдромом Ф.А. Богорада в сочетании с параличом Белла (односторонний идиопатический неврит лицевого нерва).
В своей работе исследователи отдали предпочтение трансконъюнктивальному введению ботулотоксина, относительно принятого ранее транскутанного, благодаря лучшей визуализации слезной железы, отсутствию частичного транзиторного птоза и синдрома «сухого глаза» [16].
Вместе с тем, эффект ботулотоксина на продукцию слезной жидкости в ряде случаев оказывается весьма нежелательным, особенно у пациентов с нормальной или даже пониженной секрецией слезы. Речь идет об инъекциях ботулотоксина в ткани век и параорбитальной области в целях коррекции блефароспазма неврологической природы и мимических морщин в эстетической медицине.
Так, при лечении блефароспазма еще в 80-е годы минувшего столетия рядом зарубежных авторов у 4-65% больных, получавших инъекции БТ-А в наружную треть верхнего и нижнего века, были обнаружены достаточно выраженные проявления синдрома «сухого глаза» (ССГ) [17,18 и др.].
Сегодня ССГ развивается практически в каждом втором случае инъекций ботулотоксина в параорбитальную область.
Так, в последние годы X.F. Huang et. аl. (2015) выявили, что ССГ развивается у 54% больных, пролеченных с использованием рассматриваемого препарата, в сроки от одной недели до одного месяца [19]. О влиянии инъекций БТ-А с целью коррекции мимических морщин в области наружного угла глаза («гусиные лапки»), на развитие ССГ также сообщают Y.O. Arat et al., M.C.Ho et al. (2014) и др. [20,21].
Развитие ксеротических изменений эпителия глазной поверхности у таких больных связано со следующими обстоятельствами.
Во-первых, БТ-А воздействует на m. сiliaris Riolani, расположенную вокруг протоков мейбомиевых желез, а также на парасимпатические волокна, иннервирующие эту мышцу. Тем самым рассматриваемый препарат ингибирует продукцию липидного компонента слезной пленки, что в свою очередь усиливает испаряемость слезной жидкости из конъюнктивальной полости.
Во-вторых, БТ-А осуществляет хемоденервацию афферентной части рефлекторной дуги слезопродукции, блокируя функционирование дополнительных слезных желез Краузе и Вольфринга, а также рефлекторную слезопродукцию, осуществляемую основной слезной железой [22,23].
Безусловно, подобные осложнения инъекций ботулотоксина следует учитывать при планировании лечебных мероприятий больным с рефлекторным блефароспазмом – с одной стороны и вовсе избегать использования БТ-А в косметических целях пациентам с клиническими признаками синдрома «сухого глаза» – с другой.
Вместе с тем, анализ рассмотренных осложнений местных инъекций ботулотоксина А в виде угнетения слезопродукции лег в основу экспериментального моделирования синдрома «сухого глаза» на лабораторных животных.
Так, O. Suwan-Аpichon et al. (2006) одними из первых предложили использовать ботулотоксин в этих целях (в эксперименте авторамииспользован ботулинический токсин типа В, вызывающий быстрый процесс хемоденервации в области холинергических синапсов и быстро диффундирующий в окружающие ткани).
Путем однократной трансконъюнктивальной инъекции ботулотоксина в основную слезную железу лабораторных мышей им удалось добиться ксеротических изменений эпителия глазной поверхности уже на 3-й день исследования, которые достигли своего максимального проявления на 2-3 неделе и сохранялись до 3 месяцев [24].
В результате K. Lekhanont et. al. (2007), B.W. Lin. et. al. (2014) стали использовать предложенную модель для доклинического изучения эффективности разрабатываемых лекарственных препаратов для лечения ССГ [25,26].
В 2013 году D.W.Kim et. al. предложили использование инъекций БТ-А для моделирования ССГ на лабораторных мышах. Ксеротические изменения начинали проявляться на 5-7 день исследования и сохранялись до 3-4 месяцев [27].
A.M. Demetriades et. al. (2013) также доказали соответствующую эффективность однократного введения и БТ-А. Объектом исследования явились лабораторные кролики, выгодно отличающиеся от мышей анатомическими размерами глазного яблока и слезных желез. При этом признаки роговично-конъюнктивального ксероза наблюдались на протяжении месяцев [28].
Нами (В.Ю.Попов и др., 2015) рассмотренная методика моделирования ССГ была модифицирована.
В указанных целях однократные инъекции БТ-А выполняли одновременно в три основные слезные железы кролика: в слезную железу, локализующуюся в височном углу глазницы, слезную железу третьего века (Гардерова железа), а также в подглазничную железу, являющуюся сильно развитым нижним концом основной железы.
Это в конечном итоге привело к развитию более выраженного ксероза эпителия глазной поверхности, что подтвердилось функциональными показателями слезопродукции, а также лабораторными исследованиями слезной жидкости [29].
И все же, наряду с провоцированием (в т.ч. моделированием) синдрома «сухого глаза», ботулотоксин А неожиданно нашел практическое применение и в лечении этого заболевания.
В литературе представлены данные об успешном применении БТ-А в виде инъекций в пальпебральную порцию круговой мышцы глаза в области слезных точек с целью задержки слезной жидкости в конъюнктивальной полости.
При этом ботулотоксин вызывает «вялый» паралич претарзальной части круговой мышцы глаза и мышцы Горнера, тем самым блокируя действия «слезного насоса», обеспечивающего активный отток слезной жидкости из конъюнктивальной полости [30-34].
Так, В.В.Атаманов и др. (2012) предложили подкожное введение БТ-А в области нижней слезной точки при синдроме «сухого глаза» средней и тяжелой степени. По результатам исследования в 71% случаев был отмечен выраженный положительный клинический результат и значительное субъективное улучшение. При этом у 64% пролеченных больных полученный эффект сохранялся в течение 4-х и более месяцев, в 36% эффект наблюдался менее 4-х месяцев и лишь в 11% случаев положительный результат достигнут не был [31].
В 2014 году А.А. Bukhari выполнил исследование, в рамках которого сравнивал эффективность подкожного введения БТ-А во внутреннюю треть нижнего века с окклюзией слезных точек постоянными силиконовыми обтураторами.
В первом случае положительный эффект в виде уменьшения субъективного дискомфорта и повышения функциональных показателей слезопродукции был достигнут у 83,3%, а во втором – лишь в 50%, т.к. в 33,3% случаев у них наблюдалась экструзия пробочки-окклюдера [32].
Сходные результаты были получены S.Sahlin et al. (2008) на фоне инъекций препарата во внутреннюю треть обоих век. В 70% случаев удалось добиться положительного результата. Эффект сохранялся не менее 3-х месяцев, а в некоторых случаях результат лечения был пролонгирован повторными инъекциями ботулотоксина [33].
В зарубежной литературе описаны единичные случаи успешного применения инъекций БТ-А также и пациентам с синдромом Съегрена.
Впервые Н. Spira et al. (1997) заметили, что при лечении выраженного блефароспазма путем подкожного ведения БТ-А у больных с синдромом Съегрена отмечается уменьшение выраженности проявлений ксеротических изменений эпителия глазной поверхности, которое сопровождалось повышением стабильности слезной пленки и, напротив, увеличением слезопродукции.
Авторы предполагают, что этот феномен связан с диффузией БТ-А в область основной слезной железы и возможным стимулирующим эффектом на слезопродукцию [34], хотя это предположение и противоречит представленным выше данным.
Таким образом, применение ботулинического токсина типа А при различных патологических состояниях, характеризующихся как слезотечением, так и, наоборот, недостаточной слезопродукцией, является достаточно перспективным методом.
Причем в ряде случаев - альтернативным многим «классическим» методикам лечения больных дакриологического профиля.
Особую роль БТ-А играет в экспериментальном моделировании синдрома «сухого глаза» на различных лабораторных животных, что может в дальнейшем успешно применяться при доклинических исследованиях эффективности новых лекарственных препаратов.
Список литературы.
1. Scott A.B. Botulinum toxin injection into extraocular muscles as an alternative to strabismus surgery // Ophthalmology. 1980. Vol.87 (10). P. 1044-1049.
2. Орлова О.Р., Яхно Н. Н. Применение ботокса (токсина ботулизма типа А) в клинической практике: руководство для врачей. Москва: Каталог; 2001.
[Orlova O.R. Jahno N. N. The use of Botox (botulinum toxin type A) in clinical practice: a guide for physicians. Moscow: Publishing House Katalog. 2001(in Russian)].
3. Comella C.L., Pullman S.L. Botulinum toxins in neurological disease // Muscle Nerve. 2004. Vol.29. P. 628-644.
4. Coskun B., Ilgit E., Onal B. et al. Dacryocystography in the Evaluation of Patients with Obstructive Epiphora Treated by Means of Interventional Radiologic Procedures // AJNR Am. J. Neuroradiol. 2012.Vol. 33 (1). P. 141-147.
5. Порицкий Ю.В., Бойко Э.В., Ушаков Н.А. Щадящая технология восстановления слезоотведения при непроходимости носослезного протока и устья слезных канальцев. В кн.: Современные проблемы офтальмологии. СПб; 2007: 205-210.
[PorickijYu.V., BojkoЕ.V., Ushakov N.A. Gentle recovery technology lachrymal passage obstructions nasolacrimal duct and the mouth of the tear ducts. In book: Modern problems of ophthalmology. Saint-Petersburg; 2007: 205-210(in Russian)].
6. Tu A.H., Chang E.L. Botulinum toxin for palliative treatment of epiphora in a patient with canalicular obstruction // Ophthalmology. 2005. Vol.112. P. 1469-1471.
7. Eustis H.S., Babiuch A. Botulinum toxin injection into the lacrimal gland for treatment of proximal nasolacrimal duct obstructions in children // J. Pediatr. Ophthalmol. Strabismus. 2014. Vol.51. P. 75-77.
8. Ziahosseini K., Albbadi Z., Malhorta R. Botulinum toxin injection for the treatment of epiphora in lacrimal outflow obstruction // Eye. 2015. Vol.29 (5).P. 656-661.
9. Малиновский Г.Ф. Слезотечение в пожилом и старческом возрасте // Медицинские новости. 2005.№ 3. С. 59–61.
[Malinovskij G.F. Epiphora at advanced and senile age. Medical news. 2005. № 3.Р.59-61 (in Russian)].
10. Whittaker K.W., Matthews B.N., Sandramouli S. The use of botulinum toxin A in the treatment of functional epiphora // Orbit.2003. Vol.22 (3). P.193-198.
11. Богорад Ф.А. Синдром «крокодиловых слёз» // Врачебное дело. 1928. №.11. С.1328-1330.
[Bogorad F.A. Crocodile tears syndrome. Medical business. 1928. №.11. P. 1328-1330 (in Russian)].
12. Baranano D. E., Miller N.R. Long term efficacy and safety of botulinum toxin A injection for crocodile tears syndrome // Br. J. Ophthalmol. 2004. Vol.88 (4). P. 588-589.
13. Riemann R., Pfennigsdorf S., Riemann E. Successful treatment of crocodile tears by injection of botulinum toxin into the lacrimal gland: a case report // Ophthalmology. 1999. Vol.106. P.2322-2324.
14. Delaney Y.M., Elston J.S. Bilateral crocodile tears in a patient with Guillain-Barre syndrome // J. Neuro-Ophthalmol. 2002. Vol.22 (2). P.113-115.
15. Kyrmizakis D.E., Pangalos A., Papadakis C.E. et al. The use of botulinum toxin type A in the treatment of Frey and crocodile tears syndromes // J. Oral. Maxillofac. Surg. 2004. Vol.62. P.840-844.
16. Falzon K., Galea M., Cunniffe G., Logan P. Transconjunctival botulinum toxin offers an effective, safe and repeatable method to treat gustatory lacrimation // Br. J. Ophthalmol. 2010. Vol.94. P. 379-380.
17. Perman K.I., Baylis H.I., Rosenbaum A.L., Kirschen D.G. The use of botulinum toxin in the medical management of benign essential blepharospasm // Ophthalmology. 1986.Vol.93. P. 1-3.
18. Dutton J.J., Buckley E.G. Long-term results and complications of botulinum A toxin in the treatment of blepharospasm // Ophthalmology. 1988.Vol.95 (11).P. 1529-1534.
19. Huang X.F., Wang K.Y., Liang Z.H. et al. Clinical Analysis of Patients with Primary Blepharospasm: A Report of 100 Cases in China // Eur. Neurol. 2015. Vol.73 (5-6). P. 337-341.
20. Arat Y.O., Yen M.T. Effect of botulinum toxin type a on tear production after treatment of lateral canthal rhytids // Ophthal. Plast. Reconstr. Surg. 2007. Vol.23 (1). P. 22-24.
21. Ho M.C., Hsu W.C., Hsieh Y.T. Botulinum toxin type a injection for lateral canthal rhytids: effect on tear film stability and tear production // JAMA Ophthalmol. 2014. Vol.132 (3). P. 332-337.
22. Knop E., Knop N., Millar T. et al. The international workshop on meibomian gland dysfunction: report of the subcommittee on anatomy, physiology, and pathophysiology of the meibomian gland // Invest. Ophthalmol. Vis. Sci.2011. Vol.52 (4).P. 1938-1978.
23. Doane M.G. Blinking and the mechanics of the lacrimal drainage system //Ophthalmology. 1981. Vol.88 (8). P. 844-851.
24. Suwan-Аpichon O., Michael R.,Ram R. et al.Botulinum Toxin B-Induced Mouse Model of KeratoconjunctivitisSicca // Investigative Ophthalmology & Visual Science. 2006.Vol.47. P. 133-139.
25. Lekhanont K., Leyngold I.M., Suwan-Apichon O. et al. Comparison of topical dry eye medications for the treatment of keratoconjunctivitissicca in a botulinum toxin B-induced mouse model // Cornea. 2007.Vol.26 (1). P. 84-89.
26. Lin B.W., Chen M.Z., Fan S.X. et al. Effect of 0.025% FK-506 eyedrops on botulinum toxin B-induced mouse dry eye // Invest.Ophthalmol.2014.Vol.56 (1).P. 45-53.
27. Kim D.W., Lee S.H., Ku S.K. et al. Transduced PEP-1 FK506 BP ameliorates corneal injury in Botulinum toxin Ainduced dry eye mouse model // BMB. 2013. Vol.46 (2). P. 124-129.
28. Demetriades A.M., Leyngold I.M., D'Anna S. et al.Intraglandular injection of botulinum toxin a reduces tear production in rabbits // Ophthal. Plast. Reconstr. Surg. 2013. Vol.29 (1). P. 21-24.
29. Попов В.Ю., Калинина Н.М., Бржеский В.В. Экспериментальная модель синдрома «сухого глаза» на почве снижения слезопродукции у кроликов породы Шиншилла // Медицинская иммунология. 2015.№3s.С. 41-42.
Popov V.Yu., Kalinina N.M., Brzheskiу V.V. The experimental model of the dry eye disease on the basis of reduction of tear production in rabbits of Chinchilla breed. Medicalimmunology.2015. № 3s. Р.41-42(in Russian)].
30. Jones L.T. Epiphora II. Its relation to the anatomic structures and surgery of the medial canthal region // Am. J. Ophthalmol. 1957.Vol.43 (2).P. 203-213.
31. Атаманов В.В., Черных В.В., Топорков И.А. Ботулотоксин «А» в комплексном лечении синдрома «сухого глаза» средней и тяжелой степени // Вестник ОГУ. 2012. №12. С. 9 -11.
[Atamanov V.V., Chernyh V.V., Toporkov I.A. Botulinus toxin A in complex treatment of dry eye syndrome of middle and high degree. Vestnik OGU. 2012. №12. Р. 9-11(inRussian)].
32. Bukhari A.A. Botulinum neurotoxin type A versus punctal plug insertion in the management of dry eye disease // Oman J. Ophthalmol. 2014. Vol.7 (2). P. 61-65.
33. Sahlin S., Chen E., Kaugesaar T. et al. Effect of Botulinum toxin injections on lacrimal drainage // Am. J. Ophthalm. 2000. Vol.129 (4). P. 481-486.
34. Spiera H., Asbell P.A., Simpson D.M. Botulinum toxin increases tearing in patients with Sjögren’s syndrome: a preliminary report // J. Rheumatol. 1997. Vol.24 (9). P. 1842-1843.
Материал для публикации на портале Орган зрения organum-visus.com любезно предоставил профессор Бржеский Владимир Всеволодович.
Внимание! Данная информация предназначена исключительно для ознакомления.
Любое применение опубликованного материала возможно только после консультации со специалистом.
Разрешается некоммерческое цитирование материалов данного раздела при условии полного указания источника заимствования: имени автора и WEB-адреcа данного раздела www.dry.eye-portal.ru, www.organum-visus.com
Рисунок подготовил Голубев Сергей Юрьевич.