Кожухов А.А., Полунина Е.В. Патология глаз при хроническом вирусном гепатите С.
Кожухов Арсений Александрович, Полунина Евгения Викторовна (Федеральное государственное бюджетное учреждение здравоохранения Центральная медико-санитарная часть No165 Федерального медико-биологического агентства России, Москва).
Кликни на картинку, увеличь изображение!
Согласно данным Всемирной организации здравоохранения 3% населения земного шара (около 170 миллионов человек) заражены вирусом гепатита С (HCV), при этом заболевание в 85% случаев переходит в хронический процесс, заканчивающийся через 15 - 25 лет циррозом или первичным раком печени [1].
В большинстве случаев вирусные гепатиты представляют собой системное заболевание, протекающее с закономерным развитием разнообразных внепеченочных проявлений, которые нередко выходят на первый план в клинической картине.
Данное положение связано с тем, что печень является ведущим органом, обеспечивающим динамическое равновесие белков, липидов, углеводов, ферментов, биологически активных веществ, а также поддержание водно-солевого баланса и кислотно-щелочного равновесия. Нарушения указанных механизмов приводит к выраженным изменениям микроциркуляторного русла, которые могут проявляться в различных органах и тканях и способствуют вторичным клиническим проявлениям.
При этом в ряде случаев внепеченочные проявления могут приобретать ведущее значение в клинической картине заболевания [2-4].
Вирус гепатита С.
Распространенность гепатита C варьирует в зависимости от континента. Так, в Соединенных Штатах около 3 миллионов человек больны хроническим гепатитом C, что составляет 1,8% от всего населения.
Самая высокая распространенность инфекции HCV на сегодняшний день в Египте. Это связано с широко распространенной парентеральной антишистосомальной терапией, которая проводилась с 1961 г. по 1986 г. [1].
Вирус гепатита C – единственный вирус рода Hepacivirus в семействе Flaviviridae, имеющий в своем составе цепочку рибонуклеиновой кислоты. Он был выявлен в 1990 как возбудитель для посттрансфузионного не-А, не-В гепатита.
По внешним параметрам - это обычный мелкий сферический вирус, имеющий оболочку. Свойства живых существ кодируются в генах, совокупность которых составляет геном. У вируса гепатита С очень маленький геном, в нем всего 1 ген, в котором зашифрована структура 9 белков. Эти белки участвуют в проникновении вируса в клетку, в создании и сборке вирусных частиц и в переключении на себя некоторых функций клетки.
Три белка вируса, участвующие в формировании вирусной частицы, называются структурными, остальные 6 белков выполняют разные ферментативные функции и называются неструктурными.
Геном вируса гепатита С представлен 1 нитью РНК, которая заключена в капсулу. Эту капсулу называют капсидом, а образующий ее белок - нуклеокапсидным белком.
Клинические проявления инфекции HCV различны.
Во время острой первичной инфекции клинические проявления редки. В большинстве случаев инфекция HCV становится хронической и протекает бессимптомно в течение многих лет, и часто приводит к хроническому гепатиту с различными степенями фиброза. У 15-20% инфицированных пациентов развивается цирроз печени с клиническими признаками печеночно-клеточной недостаточности.
Пациентам с постоянно выявляемыми уровнями РНК HCV в сочетании с повышенными уровнями трансаминаз и результатами биопсии печени, демонстрирующими фиброзное перерождение или умеренный некроз и воспаление, рекомендуют лечение с целью снижения риска развития цирроза, которое на сегодняшний день представляет комбинацию интерферона-альфа и рибавирина в течение 24- 48 недель [1,3].
Считается, что внепеченочные проявления HCV возникают вследствие поражения иммунной системы, связанной со способностью вируса к репликации в лимфоцитах, что приводит к их поражению, что в свою очередь приводит к возникновению аутоиммунной патологии.
Например, криоглобулинемия II типа, связанная с HCV-инфекцией, вызывается криоглобулиновыми комплексами.
Исследование подобных комплексов у больных с HCV-инфекцией показало, что они богаты антигенами вируса гепатита С [4]. Болезнь производит к развитию умеренного или тяжелого васкулита, выражающимися разнообразными симптомами, такими как слабость, артралгии, тромбоцитопеническая пурпура, гломерулонефрит и поражение центральной нервной системы [1].
Предполагается, что именно поражение иммунной системы при гепатите С может служить и причиной поражения глаз.
Ретинопатия, ассоциированная с гепатитом C.
У больных гепатитом С возможно развитие ишемической ретинопатии. Она может быть как следствием терапии с применением интерферона, так и проявлением системного васкулита, вызванного инфекцией.
Впервые HCV-ассоциированная ретинопатия была описана Эйбом и соавторами [5] в 1993.
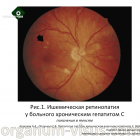
Ее проявлениями выражались кровоизлияниями в сетчатку и ватообразными очагами не связанные с проводимым лечением или системной болезнью, которая могла бы вызвать подобную патологию глаз. В 1995 году авторы расширили свои наблюдения HCV-ассоциированной ретинопатии до проспективного рандомизированного клинического исследования.
Под их наблюдением находились 85 пациентов с хроническим гепатитом C, которым не проводилось лечение. Контрольная группа состояла из 100 пациентов.
Данные анализа их исследования показали, что распространенность идиопатической ретинопатии хотя бы одного глаза у пациентов с хроническим гепатитом С составляет 31,8%, по сравнению с 6% в контрольной группе (P‹0.001). Бинокулярная ретинопатия была выявлена у 51,9 % пациентов.
Наиболее частые изменения глаз у больных с HCV-инфекцией и ретинопатией – кровоизлияния в центральную зону сетчатки, сопровождающиеся ватообразными очагами (Рис.1) [6].
В работе Майерса и соавторов [7] был описан единственный случай развития ретинопатии, подобной таковой при болезни Пурчера, у пациента с хронической HCV- инфекцией, осложненной смешанной криоглобулинемией II типа.
Внезапное снижение зрения у пациента сочеталось с абдоминальными болями. При офтальмоскопии были выявлены перипапиллярные ватообразные очаги и поверхностная бледность в макуле.
При биопсии почек были обнаружены внутрисосудистые отложения IgG, IgM и комплемента, выделяемого при смешанной криоглобулинемии II типа. Авторы вышеописанных исследований предполагают, что в основе патогенеза обнаруженных изменений лежит окклюзия сосудов сетчатки микроэмболами, состоящими из иммунных комплексов и комплемента.
Подобный комплемент-обусловленный механизм может привести к скоплению гранулоцитов в пределах сосудистой сети сетчатки, которая, в свою очередь, приводит к выделению воспалительных медиаторов и ишемии. Такая гипотетическая последовательность, подтверждается и данными исследования Агнелло и др. [4], которые описывают связь смешанной криоглобулинемии с сопутствующей HCV-инфекцией.
Таким образом, можно сделать вывод, что существуют клинические и теоретические признаки возможности возникновения ишемической ретинопатии в сочетании с криоглобулинемией у больных хроническим вирусным гепатитом С.
Но для подтверждения и уточнения патогенеза этих поражений необходимо проводить дальнейшие исследования, которые помогут нам более детально изучить изменения со стороны глаз при хронической HCV-инфекции.
Синдром сухого глаза.
На сегодняшний день проведено большое количество исследований, направленных на выяснение возможности ассоциации синдрома сухого глаза или синдрома Съегрена с хроническим гепатитом С.
Так Йоргенсен и соавторы [5] пришли к выводу, что у 19% пациентов в их отделении ревматологии, у которых был выявлено сочетание системного заболевания с синдромом сухого глаза, страдают хроническим гепатитом С.
А Какуб и соавторы [6] сообщали, что 10%, инфицированных HCV- инфекцией, из 321 пациентов, участвующих в их исследовании, предъявляли жалобы на сухость во рту и/или ощущение сухости глаз.
Синдром Съегрена - системное аутоиммунное заболевание, характеризующееся сухостью слизистых ротовой полости (ксеростомия) и глаза (ксерофтальмия).
Это связано с характерной лимфоцитарной инфильтрацией слезных и слюнных желез [7]. В 1992 Хаддад и соавторы [8] сообщили о возможной ассоциации между синдромом Съегрена и HCV-инфекцией, так как они обнаружили гистологические изменения, характерные для синдрома Съегрена лабиальных слюнных железах у 16 из 28 пациентов (58%), инфицированных HCV, при сравнении с 1 пациентом из 20 (5%) в контрольной группе (P‹0.01).
Это доказывает возможность связи синдрома Съегрена с хроническим вирусным гепатитом С, или возможность сочетания отдельных симптомов, имитирующих первичный синдром Съегрена.
У пациентов с сочетанием HCV- инфекции и синдрома Съегрена гораздо сильнее выражена неврологическая симптоматика и слабее суставные поражения, чем у пациентов с синдромом Съегрена без гепатита С [5].
В другом клиническом исследовании [9] было отмечено большое количество клинических и серологических различий между первичным синдромом Съегрена и его ассоциацией с хронической HCV-инфекцией.
Начало заболевания у пациентов с сочетанием гепатита С и синдрома Съегрена было в гораздо более позднем возрасте и имело меньшую степень повреждения ушной слюнной железы, но более высокую степень поражения печени, уровень антимитохондриальных антител в крови, степень криоглобулинемии и другие серологические различия.
Эйб и соавторы [10] попытались количественно определить эффект лимфоцитарной инфильтрации на экзокринную функцию слезных желез. Группа сравнила время разрыва слезной пленки и концентрацию лактоферрина в слезной жидкости у пациентов инфицированных вирусом гепатита С по отношении к контрольной группе не инфицированных пациентов.
Ими было выявлено укорочение времени разрыва (P‹0.005) и снижение концентрации лактоферрина (P‹0.005) по сравнению со здоровыми пациентами группы контроля.
Тем не менее, жалобы, характерные для синдрома сухого глаза, в инфицированной группе предъявляли только 3 из 42 пациентов (7.1%).
Механизм изменений слюнной и слезной желез при сочетании хронического вирусного гепатита С и синдрома Съегрена неясен.
Считается, что механизмы экзокринной дисфункции желез включают прямое воздействие HCV-вируса на клетки железы и молекулярную мимикрию между железой и вирусом, что приводит к аутоиммунной реакции на ткань слезной железы.
В дальнейшем реакция развивается по средствам отложения иммунных комплексов и/или лимфоцитарной инфильтрации [9].
Койке и др. [11] описали лимфоцитарную инфильтрацию слюнных и слезных желез, похожую на таковую при синдроме Съегрена, у мышей, инфицированных вирусом гепатита С. При исследовании было обнаружено наличие антигенов HCV в ткани слюнной железы, что позволило выдвинуть гипотезу, о влиянии на инфильтрацию слюнных желез лимфоцитами.
Таким образом, можно сказать, что у пациентов с гепатитом С велика вероятность развития синдрома сухого глаза. И офтальмологам следует рекомендовать проведение серологического исследования для выявления инфицированности хроническим вирусным гепатитом С у пациентов с идиопатическим синдромом сухого глаза.
Язва Морена и хронический вирусный гепатит C.
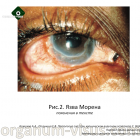
Язва Морена - редкая форма периферического кератита (Рис 2). Обычно это довольно болезненное одно- или двустороннее заболевание глаза. На ранних стадиях оно обычно ограничено периферией роговицы, но в конечном итоге поражение может вовлечь всю роговицу, которая замещается тонкой васкуляризированной мембраной, что в конце концов приводит к перфорации.
Это заболевание относиться к довольно редким, вследствие чего данные об этиологии и патогенеза крайне скромны [12].
В 1990-ых, на примере нескольких клинических случаев рассматривали ассоциацию между HCV-инфекцией и язвой Морена [13-15].
В 1994 Вилсон и соавторы [14] сообщили о двух пациентах с клиническими проявлениями характерными для язвы Морена у больных с хронической HCV-инфекцией. Оба пациента страдали тяжелым двусторонним кератитом с изъязвлением, который не реагировал на лечение циклоспорином и системными глюкокортикостероидами.
В обоих случаях, положительный результат на терапию был достигнут только при использовании интерферона-альфа-2b. Авторы оценили вероятность сочетания язвы Морена и хронического вирусного гепатита С, вероятность оказалась 1:10.000.
Вилсон и соавторы [14] и Баратц и соавторы [15] также наблюдали несколько клинических случаев, связывающих язву Морена и HCV-инфекцию. Ими Они предполагали, что HCV-инфекция вызывала аутоиммунную реакцию против антигенов роговицы, а также что поражение роговицы возникало вследствие прямого поражения клеток, на которых были представлены антигены вируса гепатита С.
В Индии проведено единственное контролируемое исследование. Оно преследовало цели выяснения особенности течения редких системных заболеваний у пациентов, страдающих хроническим гепатитом С, включая язву Морена, распространенность которой в Индии составляет 1-2%, что сравнимо с её распространенностью в Соединенных Штатах [15].
В исследовании участвовал двадцать один пациент с язвой Морена, контрольную групп составляли 40 здоровых пациентов. Все пациенты в исследуемой группе были подробно опрошены с прицельным выяснением анамнеза заболевания и осмотрены офтальмологом, также были проведены все необходимые серологические исследования на маркеры различных заболеваний, включая антитела HCV.
В ходе исследования не было выявлено ассоциации между язвой Морена и HCV [16]. Возможно, причиной этого служат генетические различия населения южной Индии или различия генотипов HCV.
Однако в других странах подобное исследование не проводилось.
Таким образом, предложенная связь между инфекцией HCV и язвой Морена остается неподтвержденной никакими данными кроме приведенных выше клинических случаев.
Список литературы:
1. Полунина Т.Е., Маев И.В., Полунина Е.В. // Гепатология для практического врача //Авторская академия - 2009
2. Centers for Disease Control. Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. MMWR Recomm Rep. October 16, 1998, 47(RR-19):9.
3. International Consensus Conference On Hepatitis C. Paris, 26–28, February 1999. Consensus Statement EASL, J Hepatol 1999, 30:956–61.
4. Agnello V, Chung RT, Kaplan LM: A role for hepatitis C virus infection in type II cryglobulinemia. N Engl J Med 1992, 327:1490–1495.
5. Jorgensen C, Legouffe MC, Perney P, et al: Sicca syndrome associated with hepatitis C virus infection. Arthritis & Rheumatism 1996, 39(7):1166–71
6. Cacoub P, Renous C, Rosenthal E, et al: Extrahepatic manifestations associated with hepatitis C virus infection: a prospective multicenter study of 321 patients. Medicine 2000, 79:47–56.
7. Fox RI, Stern M, Michelson P: Update in Sjo gren syndrome. Curr Opin Rheumatol 2000, 12:391–398.
8. Haddad J, Deny P, Munz-Gotheil C, et al: Lymphocytic sialadenitis of Sjo gren’s syndrome associated with chronic hepatitis C virus liver disease. Lancet 1992, 339:321–323.
9. Ramos-Casals M, Garcia-Carrasco M, Cervera R, et al: Hepatitis C virus infection mimicking primary Sjo gren syndrome. Medicine 2001, 80:1–8.
10. Abe T, Nakajima A, Matsunaga M, et al: Br J Ophthalmol, 83:684–687.
11. Koike K, Moriya K, Ishibashi K, et al: Sialadenitis histologically resembling Sjo gren syndrome in mice transgenic for hepatitis C virus envelope genes. Proc Natl Acad Sci USA 1997, 94:233–236.
12. Zegans ME, Srinivasan M: Mooren’s ulcer. Int Ophth Clin 1998, 38:81–88. 26 Baratz KH, Fulcher SFA, Bourne WM: Hepatitis C-associated keratitis. Arch Ophthalmol 1998, 116:529–530.
13. Moazami G, Auran JD, Florakis GJ, et al: Interferon treatment of Mooren’s ulcers associated with hepatitis C. Am J Ophthal 1995, 1193:365–366.
14. Wilson SE, Lee WM, Murakami C, et al: Mooren-type hepatitis C virusassociated corneal ulceration. Ophthalmology 1994, 101:736–745.
15. Heintges T, Ward JR: Hepatitis C virus: epidemiology and transmission. Hepatology 1997, 26:521–526.
16. ZegansME, SrinivasanM, McHughT, et al: Mooren ulcerin SouthIndia: serologyand clinical risk factors. Am J Ophthal 1999, 128:205–210.
Опубликовано: XII Всероссийская Школа офтальмолога. Сборник научных трудов. Москва, 2013., стр. 363-368.
ВШО-2013, Снегири. Red Eye. Mooren ulcerin.
Внимание! Данная информация предназначена исключительно для ознакомления.
Любое применение опубликованного материала возможно только после консультации со специалистом.
Разрешается некоммерческое цитирование материалов данного раздела при условии полного указания источника заимствования: имени автора и WEB-адреcа данного раздела www.dry.eye-portal.ru, www.organum-visus.com
Рисунки подготовил Голубев Сергей Юрьевич.